Actinídeos
Actinídeos
Radioativos e pesados, eles são metais de transição interna
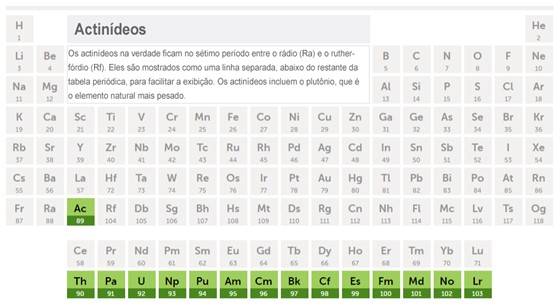
A série dos actinídeos forma o período 7 da tabela periódica, e são elementos denominados metais de transição interna. Esta série contém 15 elementos de números atômicos 89 (actínio) a 103 (laurêncio) situados entre o rádio e o rutherfórdio na tabela periódica. Este conjunto de elementos recebe este nome por causa do primeiro elemento da série, o actínio, e seus elementos ficam agrupados na mesma série porque a estrutura de suas camadas eletrônicas é igual. Na maioria das tabelas periódicas esta série fica em uma lista separada abaixo da tabela, para ser mais facilmente visualizada. [1]
A série dos actinídeos contém os elementos actínio, tório, protactínio, urânio, netúnio, plutônio, amerício, cúrio, berquélio, califórnio, einstênio, férmio, mendelévio, nobélio e laurêncio. Os actinídeos são análogos aos lantanídeos e resultado do preenchimento de orbitais 5f, assim como os lantanídeos resultam do preenchimento de orbitais 4f. Antes de 1940 apenas eram conhecidos os actinídeos de ocorrência natural, actínio, tório, protactínio e urânio, os restantes foram produzidos artificialmente desde então. [2]
Todos estes elementos têm alta diversidade quanto à oxidação e todos são radioativos. O mais conhecido deles é o urânio, usado como combustível nuclear quando convertido em plutônio por meio de uma reação nuclear. [3]
Os actinídeos são metais de cor prateada, são reativos, como o lantânio e os lantanídeos. Reagem com água quente, e perdem o brilho quando expostos ao ar, formando um revestimento de óxido. Reagem com oxigênio, com os halogênios e com hidrogênio. [4]
Usos dos actinídeos

O urânio é um elemento importante porque é a fonte do combustível nuclear usado para gerar eletricidade em usinas nucleares. Ele também é utilizado para dar origem a outros elementos transurânicos, ou seja, elementos químicos artificiais com números atômicos superiores a 92. O urânio é utilizado com fins militares em submarinos e em armas nucleares. O urânio não tem papel biológico e é um metal tóxico. Muito do calor interno da Terra se deve ao decaimento natural dos depósitos de urânio e de tório. [5]
O tório é um importante agente de ligas com magnésio, já que confere grande força a altas temperaturas. O óxido de tório é usado como catalisador industrial. O tório também pode ser usado como fonte de energia nuclear. [6]
O isótopo 238-plutônio foi a fonte de energia para o gerador da missão lunar Apolo 12. Ele gerou menos de 1,5 kW de calor convertido em eletricidade por elementos termoelétricos. Esse isótopo também foi a fonte de energia para satélites e missões espaciais. Ele fornece energia para marcapassos cardíacos, e sua vantagem é que amplia o tempo de uso desses dispositivos. [3]
O califórnio é um forte emissor de nêutrons. O isótopo Califórnio-252 é utilizado em detectores de metais, para identificar minérios de ouro e prata. O califórnio-252 é caro e apresenta riscos de manuseio devido à sua radioatividade, por isso não é a escolha preferencial para essa aplicação específica na indústria de mineração. Como forte emissor de nêutrons, o califórnio também é utilizado para encontrar camadas de óleo e água em poços de óleo, e para detectar a fadiga e o estresse de metais em aeronaves. [7]
O isótopo 241-amerício é usado como fonte de ionização nos detectores de fumaça. [3]
O cúrio é produzido em quantidades mínimas pelo bombardeio de plutônio em um reator nuclear. Ele fornece energia ao equipamento elétrico utilizado em missões espaciais. [8]
O protactínio apresenta supercondutibilidade em temperaturas abaixo de 1,4 K, além de 29 isótopos conhecidos. Destes apenas dois são naturais, de massas 231 e 234. A maior parte do protactínio é obtido de resíduos nucleares de urânio.
O netúnio pode ser utilizado na composição de equipamentos para a detecção de nêutrons, em pesquisas para produção de armas nucleares e como combustível nuclear. [9]
As primeiras quantidades visíveis de um composto de berquélio, cloreto de berquélio (BkCl3) foram produzidas em 1962 e pesavam cerca de 3 bilionésimos de grama (0,000000003 gramas). Oxicloreto de berquélio (BkOCl), fluoreto de berquélio (BkF3), dióxido de berquélio (BkO2) e trióxido de berquélio (BkO3) foram identificados e estudados com um método conhecido como difração de raios X. O berquélio e os outros actinídeos, einstênio, férmio, mendelévio, nobélio e laurêncio, não têm aplicações fora do campo de pesquisa. [10]
A areia monazítica contém até cerca de 10% de tório, além de lantanídeos. O tório também é encontrado no minério torita, ThSiO4. O urânio é extraído do minério pechblenda, UO2. Quantidades muito pequenas de actínio, proactínio, netúnio e plutônio foram detectadas nesses minérios. Esses quatro elementos só podem ser obtidos sinteticamente. [4]
O plutônio forma-se em grandes quantidades a partir do urânio usado como combustível em reatores nucleares. [4]
Vídeo da Universidade de Nottingham com legendas em inglês mostra o manuseio de vários actinídeos radioativos no Laboratório Nacional de Engenharia Radioquímica de Oak Ridge, nos Estados Unidos. Assista:
História

Em 1789 Martin Klaproth examinou o minério pechblenda e descobriu que ele continha um novo elemento, que chamou de uranium em homenagem ao recém-descoberto planeta Urano. Mais tarde, em 1828, Jacob Berzelius obteve um óxido a partir de um mineral da Noruega, hoje conhecido como torita; deu a ele o nome de thoria em homenagem ao deus escandinavo da guerra, e por redução de seu tetracloreto com potássio isolou o metal tório. [2]
O elemento protactínio, muito mais raro, não foi encontrado até 1913, quando Kasimir Fajans e Otto Göhring identificaram protactínio-234 como um integrante instável da série de decaimento de urânio-238. Eles denominaram-no de breve por causa de sua curta meia vida, de apenas 6,7 horas. O isótopo mais estável protactínio-231 foi identificado três anos depois por Otto Hahn e Lisa Meitner e independentemente por Frederick Soddy e John Cranston como resultado do decaimento de urânio-235. Em referência ao actínio, ele foi nomeado protoactinium, nome encurtado em 1949 para protactinium. Por causa de sua baixa abundância natural, sua química continuou obscura até 1960, quando Alfred Maddock e colegas da Autoridade de Energia Atômica do Reino Unido trabalharam com 130 gramas do elemento retiradas de 60 toneladas de lama acumulada do minério dióxido de urânio. Foi desta amostra, distribuída para numerosos laboratórios em todo o mundo, que a maior parte do conhecimento sobre a química do protactínio foi obtida. [2]
No início do século XX a tabela periódica terminava no elemento 92, o urânio, mas com a descoberta de James Chadwick sobre a existência do nêutron em 1932, a síntese de novos elementos se tornou uma possibilidade emocionante. Enrico Fermi e outros partiram rapidamente para tentarem a síntese do elemento 93 pelo bombardeamento de nêutrons de urânio 238, mas gradualmente tornou-se evidente que o principal resultado do processo não era a produção do elemento 93, mas a fissão nuclear, que produz elementos mais leves. [2]

Os demais elementos actinídeos foram preparados por várias técnicas de bombardeamento pelos próximos 25 anos, embora, por razões de segurança nacional, a publicação dos resultados fosse prejudicada. A figura dominante nesta área foi a de Glenn Seaborg, da Universidade da California, em Berkeley, que junto com Edwin McMillan, ganhou o Prêmio Nobel de Química de 1951 por suas descobertas sobre a química dos elementos transurânicos. [2,11]
Seaborg foi um dos descobridores do plutônio e de todos os elementos transurânicos seguintes até o elemento 102, em colaboração com Albert Ghiorso, também da Universidade da California, entre outros cientistas. Além disso, Seaborg e seu grupo foram responsáveis pela identificação de mais de 100 isótopos de elementos da tabela periódica. [11]
O isolamento e a caracterização dos actinídeos, particularmente os mais pesados, foram tarefas problemáticas. Elementos individuais não são produzidos diretamente em isolamento, mas têm que ser separados de outros actinídeos, bem como de lantanídeos produzidos simultaneamente por fissão. Some-se a isso o fato de que todos os actinídeos são radioativos, sua estabilidade decresce enquanto aumenta o número atômico, e isto tem duas graves consequências. Primeiro, é necessário dispor de uma complexa proteção contra a radiação, e por isso muitas operações têm que ser realizadas por controle remoto. Segundo, porque os elementos mais pesados são produzidos em quantidades ínfimas. O mendelévio foi inicialmente preparado em quantidade inacreditavelmente reduzida, da ordem de 1 a 3 átomos por experimento. [2]
Diante das quantidades envolvidas, especialmente do califórnio e elementos descobertos posteriormente, está claro que isto não seria possível sem precisas previsões sobre suas propriedades químicas. Foi devido às pesquisas de Seaborg que esses elementos puderam ser considerados como uma segunda série f, tal como os lantanídeos. Tório, protactínio e urânio anteriormente eram considerados elementos de transição, que pertenceriam aos grupos 4,5 e 6, respectivamente. [2]
Referências
1-Actinides. Disponível em https://www.rsc.org/periodic-table. Acesso em 06/10/2022.
2-N., G.; A., E. Chemistry of the Elements. Oxford: Butterworth Heinemann, 1997.
3-General Properties and Reactions of The Actinides. Disponível em https://is.gd/propriedades_actinideos. Acesso em 07/10/2022.
4-LEE, J. D. Química inorgânica não tão concisa. 1ª Reimpressão. ed. São Paulo: Edgard Blucher, 1996.
5-Uranium. Disponível em https://www.rsc.org/periodic-table/element/92/uranium. Acesso em 17/10/2022.
6-Thorium. Disponível em https://www.rsc.org/periodic-table/element/90/thorium. Acesso em 17/10/2022.
7-Californium. Disponível em https://www.rsc.org/periodic-table/element/98/californium. Acesso em 17/10/2022.
8-Curium. Disponível em https://www.rsc.org/periodic-table/element/96/curium. Acesso em 17/10/2022.
9-Neptunium. Disponível em https://www.rsc.org/periodic-table/element/93/neptunium. Acesso em 03/10/2023.
10-The Element Berkelium. Disponível em https://education.jlab.org/itselemental/ele097.html. Acesso em 03/10/2023.
11-Glenn T. Seaborg. Disponível em https://www.nobelprize.org/prizes/chemistry/1951/seaborg/biographical/. Acesso em 11/10/2022.
ATENÇÃO! Os experimentos com substâncias químicas mostrados nos vídeos aqui incluídos só devem ser reproduzidos na presença de um profissional ou professor de química, e em ambiente controlado. Não tente reproduzir esses experimentos por conta própria.
Texto produzido pela jornalista Mari Menda da Gerência de Relações Institucionais
do CRQ-SP sob a supervisão de
Márcia Guekezian, coordenadora do curso de Engenharia Química da Faculdade de São Bernardo do Campo
Publicado em 11/10/2023


