Elementos Químicos – Silício
Elementos Químicos – Silício
Um elemento de grande importância desde a idade da pedra
por Karem Soraia Garcia Marquez

Silício, representado pelo símbolo Si, é o elemento químico de número atômico 14 e massa atômica 28,09 u. Pertence ao grupo 14, ou família 4A da tabela periódica. Apresenta propriedades intermediárias entre as do carbono e o germânio. À temperatura ambiente é um sólido duro, porém frágil e pouco maleável (difícil de moldar), ao contrário dos metais. Sua coloração é cinza escuro e possui brilho metálico característico. Apresenta baixa densidade (2,33 g.cm-3). Seu ponto de fusão é 1.414 ºC e o ponto de ebulição é 3.265 ºC.
As principais variedades alotrópicas são: silício amorfo e cristalino. O silício amorfo (a-Si) é a forma não cristalina de silício utilizada e em células solares e películas de telas LCD. O silício cristalino tem estrutura semelhante à do diamante, em que cada átomo fica no centro de um tetraedro formado pelos quatro vizinhos mais próximos, todos formando ligações covalentes. Devido às suas propriedades intermediárias entre os elementos metálicos e não metálicos, o silício é comumente classificado como semimetal1,2.
Em contato com o ar atmosférico, interage com o gás oxigênio, formando uma camada muito fina de óxido de silício (SiO2) na sua superfície, o que o torna resistente à corrosão. É um elemento relativamente inerte, não sendo atacado pela água e nem pela maioria dos ácidos, porém, reage com ácido fluorídrico, ocorrendo a sua dissolução, com formação de ácido hexafluorossilícico (H2SiF6). É atacado por bases, como solução aquosa de hidróxido de sódio, formando silicatos. Também reage com halogênios, formando seus respectivos haletos.
Os principais isótopos do silício são: o Si-28, que é o mais comum (92,23%), o Si-29 (4,67%) e o Si-30 (3,1%), todos eles naturais e estáveis. O silício é o sétimo elemento mais abundante no universo. Na crosta terrestre é o segundo elemento mais abundante, constituindo 27,7% da sua composição. Na natureza, ocorre sempre combinado, principalmente na forma de óxidos ou silicatos. Os óxidos, conhecidos como sílica (SiO2) incluem areia, quartzo, cristal de rocha, ametista, ágata, sílex e opala. Quimicamente, os silicatos são grupos aniônicos contendo silício e oxigênio associados e ocorrem sob diversas formas como os ortossilicatos (SiO44-) e os metassilicatos (SiO32-). Os silicatos constituem a maior e mais importante classe de minerais formadores das rochas. As formas de silicatos mais comuns incluem o amianto, o feldspato, as argilas e as micas3.
O silício é um elemento necessário para a vida vegetal e animal. Alguns organismos aquáticos, como as diatomáceas e esponjas, por exemplo, usam o elemento na sua constituição estrutural, formando esqueletos e carapaças.
O nome do elemento silício tem origem na palavra sílex (do latim): um mineral muito duro, utilizado desde a pré-história para fabricação de ferramentas de corte, pontas de flechas e também para produzir fogo por atrito. As civilizações antigas usavam ainda outras formas de sílica, como o cristal de rocha, e também sabiam como obter o vidro a partir da areia.
A descoberta do silício é atribuída ao químico sueco Jöns Jacob Berzelius. Ele obteve o silício a partir da reação entre hexafluorossilicato de potássio (K2SiF6) com potássio metálico. Nos dias atuais o silício elementar é produzido comercialmente pela redução da sílica com carbono em fornos elétricos, a temperaturas elevadas, como mostra a reação a seguir4:
![]()
O silício de alta pureza, utilizado na indústria eletrônica, é preparado pela decomposição térmica do triclorosilano ultrapuro (HSiCl3), seguida de recristalização. O silício obtido por esse método e por outros similares apresenta uma fração de impurezas de uma parte por bilhão ou menos e é denominado silício policristalino.
O elemento no seu estado hiperpuro é amplamente utilizado como semicondutor em dispositivos de estado sólido, nas indústrias de computador e microeletrônica. O Vale do Silício, localizado na Califórnia, Estados Unidos, recebeu este nome por ser um importante polo da indústria de componentes eletrônicos, que empregam esse elemento na sua composição. Esse apelido apareceu pela primeira vez em 1971 no jornal Electronic News5.
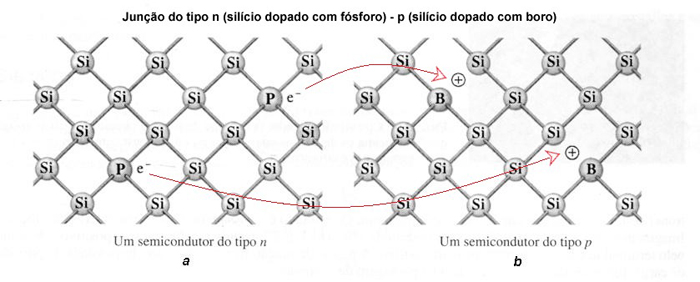
O silício hiperpuro utilizado nos semicondutores é dopado (impurificado) seletivamente com pequenas quantidades de boro, gálio, fósforo ou arsênio para controlar suas propriedades elétricas. Os dispositivos eletrônicos que operam pelas propriedades elétricas de uma junção do tipo p-n, são formados por um semicondutor do tipo p (silício dopado com boro ou gálio), adjacente a um semicondutor do tipo n (silício dopado com fósforo ou arsênio). O semicondutor do tipo p é deficiente em elétrons, pois a dopagem é feita com átomos que possuem na camada de valência um elétron a menos que o silício. Por outro lado, o semicondutor do tipo n possui elétrons excedentes, pois é dopado com átomos que possuem na camada de valência um elétron a mais que o silício. A junção do tipo p-n, estabelece um fluxo de elétrons no sentido do semicondutor n para p, permitindo que a corrente elétrica passe a fluir em um único sentido, como mostra a figura a seguir. Isso é fundamental para a conversão de corrente alternada em corrente contínua.
Os principais tipos de células fotovoltaicas são constituídos de silício, podendo ser amorfo ou cristalino. Esses dispositivos são capazes de converter a energia solar em energia elétrica e são atualmente empregadas nos painéis solares7. Por exemplo, se um semicondutor do tipo p-n for irradiado com energia luminosa suficiente para romper algumas ligações, pode promover um fluxo de elétrons da região tipo n para a região tipo p. Dessa forma, uma corrente elétrica é gerada a partir da luz incidente, obtendo-se uma célula fotovoltaica.

A maior utilização do silício é na composição de ligas metálicas importantes, incluindo alumínio-silício e ferro-silício, utilizadas para fazer placas de transformadores, blocos de motor e ferramentas8.
O carbeto de silício (SiC), também conhecido como carborundo é um importante composto de silício, utilizado na indústria como abrasivo, devido à sua elevada dureza, somente superada pela do diamante.
A utilização do silício na indústria de materiais cerâmicos também é de grande relevância. As argilas (constituídas por aluminossilicatos hidratados) são a principal matéria-prima das cerâmicas brancas, utilizadas na produção de louças e porcelanas. Elas também são a base das cerâmicas vermelhas, utilizadas na produção de tijolos, telhas e utensílios. O cimento é obtido pelo aquecimento de argilas com calcários em grandes fornos rotativos a altas temperaturas. O vidro tem a sílica como principal componente, misturada a outros materiais, dependendo da sua finalidade.
Outra importante aplicação do silício é na composição da sílica gel, uma variedade amorfa de SiO2, obtida industrialmente pela acidificação de soluções aquosas de silicato de sódio. Apresenta elevado poder de retenção da umidade, sendo amplamente utilizada, por exemplo, na preservação de produtos como alimentos e medicamentos, granulados sanitários para gatos e nos laboratórios de química como dessecante. A sílica gel pode absorver mais de 40% do seu próprio peso de água e pode ser regenerada por aquecimento9.
O elemento é utilizado, ainda, na produção de silicones ou polisiloxanos. Estes são materiais poliméricos que apresentam o silício em ligações com o elemento oxigênio de forma alternada, formando longas cadeias, com grupos metila (ou outros grupos orgânicos como fenila e etila) presentes, de modo a formar quatro ligações, conforme a estrutura mostrada a seguir:

Os silicones são quimicamente inertes, resistentes ao calor, além de serem bons isolantes elétricos. Algumas das mais importantes aplicações do silicone incluem utensílios e formas culinárias, colas e lubrificantes, além das próteses utilizadas em medicina e em produtos cosméticos1,3.
Alguns compostos de silício, como o amianto, são prejudiciais à saúde. A inalação de suas formas particuladas (microfibras presentes no ar) que podem ser liberadas durante a sua extração, utilização ou descarte, podem causar uma doença pulmonar conhecida como silicose. Devido a esse problema, em vários países, inclusive no Brasil, o uso do amianto já foi proibido8,10.

As aplicações do silício nas mais diversas áreas têm sido relevante, desde os tempos mais remotos, partindo da pré-história até a época atual, abrangendo uma ampla gama de materiais, como polímeros, cerâmicas, fibras ópticas e componentes eletrônicos. Essas são características que mostram a importância estratégica do silício para o progresso da humanidade, sendo fundamental para o desenvolvimento de setores como a construção civil, informática, energia solar, telecomunicações e medicina, dentre muitos outros.
Referências
1. PEIXOTO, Eduardo Motta Alves. Química Nova na Escola – Elemento Químico: Silício N° 14, Nov. 2001. Disponível em: http://qnesc.sbq.org.br/online/qnesc14/v14a12.pdf. Acesso em 06 abr. 2021.
2. https://www.tabelaperiodica.org/usos-aplicacoes-silicio/ Acesso em 06 abr. 2021.
3. https://www.rsc.org/periodic-table/element/14/silicon. Acesso em 06 abr. 2021.
4. ABEL, J. L. Obtenção do Carboneto de Silício pela redução carbotérmica da sílica. São Paulo, 2009. Dissertação de Mestrado. Universidade de São Paulo. Disponível em: https://teses.usp.br/teses/disponiveis/85/85134/tde-16112009-133532/pt-br.php. Acesso em 01 set. 2021.
5. https://www.livescience.com/28893-silicon.html. Acesso em 06 abr. 2021.
6. SOTELO, A. F. et al. Tópicos de Química para Engenharia. Editora Plêiade, São Paulo, 2004.
7. SAMPAIO, João Alves et al. Silício Grau Solar – Uma Revisão das Tecnologias de Produção. CETEM/MCTIC. Rio de Janeiro, 2019. Disponível em https://www.cetem.gov.br/. Acesso em 06 abr. 2021.
8. https://www.thoughtco.com/interesting-silicon-element-facts-4115656. Acesso em 06 abr. 2021.
9. GOMES, L. S.;* FURTADO, A. C. R.; SOUZA, M. C. A Sílica e suas Particularidades. Rev. Virtual Quim. Data de publicação na Web: 16 de agosto de 2018. Disponível em http://static.sites.sbq.org.br/rvq.sbq.org.br/pdf/v10n4a19.pdf. Acesso em 06 abr. 2021.
10. https://intertox.com.br/uso-de-amianto-e-proibido-no-brasil/. Acesso em 06 abr. 2021.
*Docente do Centro Universitário Fundação Santo André.
Publicado em 03/09/2021



