Elementos Químicos – Enxofre
Elementos Químicos – Enxofre
Um ícone da indústria química citado na Bíblia

Yahweh, o próprio Deus, fez chover do céu fogo e enxofre sobre Sodoma e Gomorra. Assim Ele destruiu completamente aquelas cidades e toda a planície, com todos os habitantes das cidades e toda a vegetação ao redor. Gênesis 19.
O enxofre é assim: poderoso e utilizado desde épocas remotas na história da humanidade, citado na Bíblia e, talvez, por todos estes motivos, seja intrinsecamente associado a crenças e religiões. Mas, ao mesmo tempo, é um elemento químico que assume vários papéis, desde o biológico, dentro das nossas células e das de plantas, até como protagonista do composto químico mais utilizado pela indústria em todo o mundo: o ácido sulfúrico. Não é pouca coisa.
Amarelo e tóxico
O enxofre é um sólido amarelo-claro, inodoro, insolúvel em água, que queima com facilidade. É mau condutor de calor, tem brilho resinoso e ocorre na forma elementar, ou seja, como substância simples, em depósitos vulcânicos. Ele é mais abundante como sulfeto, quando acompanha um metal. [1]
Na Tabela Periódica o enxofre está no grupo 16, dos calcogênios, junto com oxigênio, selênio, telúrio e polônio. O enxofre tem número atômico 16 e símbolo S, derivado de seu nome em sânscrito, sulvere, e do latim, sulphurium. É o décimo elemento químico mais abundante no universo. O enxofre elementar é formado principalmente por moléculas contendo oito átomos de enxofre (S8) formando uma estrutura similar a uma coroa. [2]

O enxofre aparece como componente de muitos minerais comuns, como galena (PbS), gipsita (CaSO4·2H2O), pirita (FeS2), esfalerita (ZnS), cinábrio (HgS), estibinita (Sb2S3), epsomita (MgSO4·7H2O), celestita (SrSO4) e barita (BaSO4). [2]
Originalmente o enxofre elementar (S8), retirado de depósitos subterrâneos principalmente pelo Processo Frasch, era a matéria prima para a produção de compostos de enxofre, como o ácido sulfúrico. Tal processo consome muita energia e seu sucesso comercial depende de acesso a água e energia baratas. Posteriormente ele passou a ser obtido também a partir de sulfetos, como o mineral pirita, por um processo denominado ustulação, conforme a reação a seguir:
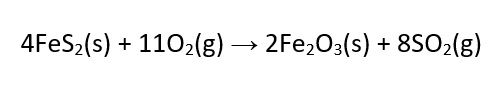
O dióxido de enxofre (SO2) liberado na ustulação é, posteriormente, transformado em trióxido de enxofre (SO3) e ácido sulfúrico (H2SO4).
Desde o início do século XXI o enxofre é obtido principalmente como subproduto do refino de petróleo, no qual se encontra como parte das moléculas orgânicas, e pela remoção do gás sulfeto de hidrogênio (H2S) presente no gás natural. Ele também é obtido em processos metalúrgicos com metais não ferrosos, como cobre e zinco. A obtenção do enxofre elementar a partir do gás natural e do petróleo pelo processo Claus é cada vez mais importante. Nesse processo, o H2S é primeiramente oxidado a altas temperaturas e, em uma etapa posterior, o dióxido de enxofre (SO2) que resulta desta etapa reage com o sulfeto de hidrogênio restante sobre um catalisador. [3]
Estas formas de produção mais recentes surgiram para cumprir legislações bastante restritivas no mundo e no Brasil quanto à redução de emissões de compostos de enxofre para a atmosfera provenientes da produção de combustíveis fósseis, e para reduzir ou eliminar gases contendo enxofre gerados durante os processos metalúrgicos. [4]
Poucos países, como a Polônia, que possuem reservas de enxofre elementar, ainda utilizam o Processo Frasch, mas a produção diminui a cada ano. Aqui no Brasil, em função da legislação ambiental, a Petrobrás remove os compostos sulfurosos que existem em pequenas quantidades nos combustíveis derivados de petróleo, como o diesel e a gasolina. Ao retirar o enxofre, os combustíveis tornam-se menos poluentes para o ar. [5, 6]
Assista o vídeo produzido pela Universidade de Nottingham, no Reino Unido, e disponibilizado no canal de YouTube Periodic Table of Videos:
Cerca de 90% do enxofre consumido no mundo é convertido em ácido sulfúrico ou produzido diretamente como tal, e a maior parte do ácido sulfúrico é consumida pela indústria de fertilizantes, majoritariamente na solubilização da rocha fosfática (ver texto sobre fósforo). Além dos fertilizantes, destacam-se os usos do enxofre na indústria de papel e celulose, para fabricação de polpa de madeira; como matéria-prima para a indústria química, especialmente para a formulação de detergentes biodegradáveis; na fabricação de corantes e pigmentos; na vulcanização da borracha para aumentar sua resistência, principalmente em pneus; na formulação de inseticidas e fungicidas; em agentes alvejantes; como complemento alimentar para gado; e na produção de acetato de celulose, celofane, raiom, viscose, fibras e produtos têxteis. [7,6].

O enxofre e seus compostos são usados na fabricação da pólvora e em fármacos, como sulfas, sulfatos e antibióticos. Ele faz parte da composição de cimentos, sabão em pó e, também, líquidos para fazer permanentes no cabelo. [8]
A produção mundial de enxofre, considerando todas as formas de obtenção, foi de 80 milhões de toneladas em 2021, sendo os maiores produtores China, Estados Unidos, Rússia e Arábia Saudita. A produção brasileira foi de 500 mil toneladas naquele ano, segundo o Sumário das Commodities Minerais, publicado pelo Serviço Geológico dos Estados Unidos. [5]
No Brasil o enxofre ocorre em depósitos da bacia sedimentar de Sergipe, no município de Siriri. Volumes representativos estão contidos na pirita (FeS2) associada ao carvão da Bacia do Paraná. As reservas oficiais de enxofre no Brasil compreendem sulfetos de chumbo, ou galena (PbS) e de zinco, ou blenda (ZnS), que ocorrem em depósitos em Minas Gerais, no município de Paracatu, e São Paulo, no município de Morro Agudo. Os depósitos de enxofre associado ao ouro em Minas Gerais possuem reservas em torno de 748 mil toneladas. A reserva de enxofre contido no folhelho pirobetuminoso (comercialmente conhecido como xisto betuminoso) da Formação Irati, no Paraná, foi calculada em 47 milhões de toneladas. [1]
O enxofre ocorre nos meteoritos e está presente em grande quantidade em Io, a terceira maior lua de Júpiter. Io é o corpo com maior atividade vulcânica conhecida no sistema solar, e sua superfície mostra as cores amarela, laranja, vermelha e preta que se devem a depósitos de enxofre em diferentes temperaturas. [9]

Papel biológico
O enxofre é um elemento químico essencial a todos os organismos vivos. Ocorre no organismo humano, principalmente como constituinte de aminoácidos (cistina, cisteína e metionina). É encontrado no esqueleto, na ordem de 1,4 g por quilo de osso, na insulina e na queratina da pele, cabelos e unhas. Ele está presente em muitos alimentos, como germe de trigo, lentilha, feijão e aveia; a cebola tem um efeito lacrimogênio devido a um composto contendo enxofre. [8]
Nas plantas o enxofre exerce funções essenciais para seu desenvolvimento e qualidade, desde a formação de aminoácidos e proteínas até no controle hormonal, fotossíntese e mecanismos de defesa contra patógenos. [10]
A principal função do enxofre nas plantas é estrutural, na composição de alguns aminoácidos (cisteína, cistina, metionina, taurina) e, devido a isso ele está presente em todas as proteínas vegetais, inclusive enzimáticas. Também, de forma indireta, está envolvido na formação da clorofila. Por esse motivo o enxofre é suprido para as plantas via adubos. [11]
Por outro lado, alguns compostos de enxofre são tóxicos à saúde humana, provocam dores e diarreias e são danosos ao meio ambiente. O dióxido de enxofre (SO2) é corrosivo, oriundo da queima de combustíveis fósseis; os óxidos de enxofre presentes na atmosfera se dissolvem em água e provocam a chuva ácida, prejudicial ao meio ambiente; e o sulfeto de hidrogénio ou gás sulfídrico (H2S), produzido pela degradação anaeróbica de materiais contendo enxofre, provoca a morte por parada respiratória. [8]
O gás sulfídrico possui cheiro de ovo podre. Esse cheiro se deve à degradação anaeróbica da albumina, proteína sulfurada presente no ovo. Ele é obtido em laboratório pela ação de ácido clorídrico (HCl) sobre sulfeto ferroso (FeS). Conforme sua concentração no ambiente, ele pode afetar rapidamente o olfato antes de causar a morte. O gás sulfídrico, bem como o dissulfeto de carbono (CS2), provoca paralisia, convulsão e narcose. [8]
Alquimistas

O enxofre já era conhecido por povos sem escrita e utilizado como pigmento de pinturas em cavernas. Em diversas civilizações, sua queima fazia parte de rituais religiosos, e ele era utilizado para clarear o algodão e a lã e para a fumigação. Como medicamento dermatológico, foi empregado em unguentos. [4]
O Genesis refere-se a ele como a pedra que queima. Homero menciona o enxofre como desinfetante; os romanos usavam-no como medicamento dermatológico. Plínio considerava o enxofre como um dos tipos mais singulares de terra e um agente de grande poder sobre outras substâncias. [12]
Na Idade Média, alquimistas pensavam que o enxofre fosse uma substância mineral oleosa que podia ser derretida para se tornar um óleo combustível, e achavam que todos os materiais combustíveis continham enxofre. Em 1777, Lavoisier finalmente classificou-o como um elemento químico, mas Humphry Davy, em 1808, ainda pensava que o enxofre fosse um composto que continha oxigênio, similar às resinas. [12]
Mesmo sendo classificado como um elemento por Lavoisier, foi só na primeira metade do século XIX que os químicos franceses Gay-Lussac e Thenard demonstraram que ele é uma substância simples. [4]
Até 1838 o enxofre elementar era retirado de depósitos superficiais de origem vulcânica na Sicília, que detinha o monopólio de sua produção. Com isso os preços subiram, e a indústria buscou fontes alternativas, como as piritas, produzidas principalmente na Espanha e em Portugal, ainda na metade do século XIX. Nessa época os principais usos do enxofre eram para a fabricação de pólvora, para produção de branqueadores e para manufatura de compostos medicinais. [13]
No início do século 20, o método Frasch, nos Estados Unidos, reduziu os custos de produção e levou à hegemonia norte-americana na produção a partir de 1913. Com o advento da química industrial moderna, ao longo do século, o enxofre passou a ser aplicado sobretudo na produção do ácido sulfúrico. [13].
Referências
[1] – Enxofre-DNPM. Disponível em https://www.gov.br/anm/pt-br/centrais-de-conteudo/publicacoes/serie-estatisticas-e-economia-mineral/outras-publicacoes-1/7-4-enxofre. Acesso em 08/04/2022.
[2] – Chemistry in its Elements: Sulfur. Disponível em https://education.jlab.org/itselemental/ele016.html. Acesso em 06/06/2022.
[3] – Shriver D. et al. Química Inorgânica. 4. ed. Porto Alegre; Bookman, 2008.
[4] – Enxofre. Disponível em https://www.gov.br/anm/pt-br/centrais-de-conteudo/publicacoes/serie-estatisticas-e-economia-mineral/outras-publicacoes-1/7-4-enxofre. Acesso em 07/04/2022.
[5] – Sulfur Statistics and Information. Disponível em https://www.usgs.gov/centers/national-minerals-information-center/sulfur-statistics-and-information. Acesso em 07/04/2022.
[6] – Petrobras. Disponível em https://petrobras.com.br/pt/nossas-atividades/produtos/industriais/enxofre/. Acesso em 20/04/2022.
[7] – Souza M. Processos inorgânicos. Rio de Janeiro. Synergia Ed. 2012.
[8] – Vaitsman, D.; Dutra P.; Afonso J. Para que servem os elementos químicos. Rio de Janeiro, Interciência. 2001.
[9] – Enxofre DNPM. Disponível em https://www.gov.br/anm/pt-br/centrais-de-conteudo/publicacoes/serie-estatisticas-e-economia-mineral/sumario-mineral/sumario-mineral-brasileiro-2008/enxofre#:~:text=O%20pre%C3%A7o%20por%20tonelada%20de,destinados
%20%C3%A0%20produ%C3%A7%C3%A3o%20de%20biocombust%C3%ADveis. Acesso em 25/04/2022.
[10] – Burrows A.; Holman J.; Parsons A.; Pilling G.; Price G. Introdução à Química Inorgânica, Orgânica e Físico-Química. Vol. 3. Rio de Janeiro. LTC Livros Técnicos e Científicos.2012.
[11] – O ciclo do enxofre aplicado à agricultura e agroindústria. Disponível em http://anais.unespar.edu.br/xi_eepa/data/uploads/artigos/9/9-07.pdf. Acesso em 08/004/2022.
[12] – Enxofre: nutriente indispensável para altos rendimentos. Disponível em https://maissoja.com.br/enxofre-nutriente-indispensavel-para-altos-rendimentos/. Acesso em 25/04/2022.
[13] – Ullmann?s Encyclopedia of Industrial Chemistry. Vol. 25. 5.ed. 1994.
[14] – Enxofre. Cetem. Disponível em http://mineralis.cetem.gov.br/bitstream/cetem/1042/3/06.%20Agrominerais%20-%20ENXOFRE.pdf. Acesso em 07/04/2022.
ATENÇÃO! Os experimentos com substâncias químicas mostrados nos vídeos aqui incluídos só devem ser reproduzidos na presença de um profissional ou professor de química, e em ambiente controlado. Não tente reproduzir esses experimentos por conta própria.
Texto produzido pela jornalista Mari Menda da Gerência de Relações Institucionais
do CRQ-SP
sob orientação técnica de Vera Regina Leopoldo Constantino,
docente do Instituto de Química da USP.
Publicado em 06/10/2022



