Cloro
Cloro
Crucial, mas também perigoso

Imagine um elemento muito peculiar. O gás cloro (Cl2) é tóxico, mas, por outro lado, o elemento cloro é crucial para a vida. Seus compostos estão presentes na água que bebemos, no sal que colocamos em nossa comida e em centenas de aplicações industriais, mas alguns de seus compostos podem ser nocivos, como, por exemplo, os CFC’s que prejudicam a camada de ozônio, e o próprio gás cloro (Cl2) que já foi utilizado como arma química na 1ª Guerra Mundial.
Este elemento tão poderoso, tão útil e tão paradoxal é o cloro.
Salmouras e vulcões – O cloro tem número atômico 17 e massa atômica de 35,45u. O gás cloro (Cl2) tem um forte odor, similar ao dos alvejantes, mesmo em baixas concentrações. Altas concentrações de cloro são tóxicas para os seres humanos: o gás é detectável pelo olfato à concentração de 3 ppm (partes por milhão); causa irritação na garganta a 15 ppm; provoca tosse a 30 ppm e leva à morte rápida a 1.000 ppm. A exposição prolongada a concentrações superiores a 1 ppm deve ser evitada [1,2].
O cloro pertence à família dos halogênios na Tabela Periódica, o que significa que ele é muito reativo com metais e forma sais. Isto acontece porque os halogênios têm sete elétrons na camada eletrônica mais externa, mas precisam de oito para formar uma configuração estável. Os metais vão se ligar ionicamente com o cloro fornecendo um elétron. Assim o cloro adquire estabilidade eletrônica, formando um octeto. Dois átomos de cloro se unem através de uma ligação covalente para formar o gás Cl2 [2].
O cloro é o 19° elemento mais comum na crosta terrestre. No oceano é o terceiro elemento mais comum e o 23° elemento mais abundante no universo. Alguns vulcões emitem gás cloro (Cl2), mas na natureza o elemento cloro nunca está isolado, sempre aparece combinado com outros elementos, como halita (NaCl), silvita (KCl) e carnalita {KCl.MgCl2 6(H2O)}, e na água do mar, como componente do cloreto de sódio (NaCl) e outros sais dissolvidos [2,3].

As indústrias obtêm cloro da água do mar, de vários tipos de salmouras e também de depósitos minerais formados pelos oceanos, conhecidos como evaporitos minerais [2].
Um dos mais importantes processos para a produção do gás cloro é o da indústria cloro-álcalis que utiliza corrente elétrica para obter a partir das salmouras: o gás cloro (Cl2), hidróxido de sódio (NaOH) aquoso e gás hidrogênio (H2), conforme mostra a reação a seguir:
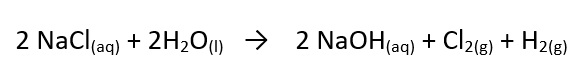
O cloreto de sódio (NaCl), ou sal de cozinha, é o composto mais abundante contendo cloro. Ele é usado para temperar os alimentos e também em processos industriais. O NaCl ocorre nos oceanos, em imensos depósitos de evaporitos, em lagos salgados e em salmouras. Este composto teve papel dominante na indústria química desde seu início, no final do século 18. O processo Leblanc, hoje obsoleto, para se obter soda cáustica (NaOH) a partir do cloreto de sódio, assinalou o início da indústria química em larga escala, e o NaCl continua sendo uma importante fonte de cloro e ácido clorídrico para a vasta indústria de cloro atual. Esta indústria abrange não só a produção e distribuição de gás de cloro (Cl2) e ácido clorídrico (HCl), mas também a produção de metano e etano clorados, cloreto de vinila, tricloreto de alumínio (AlCl3), utilizado como catalisador em sínteses de compostos orgânicos e os cloretos de Mg, Ti, Zr, entre outros, utilizados para a produção desses metais [1].
Vídeo produzido pela Universidade de Nottingham (Reino Unido) mostra características e experimentos com o cloro:

Muitos compostos de cloro podem ser encontrados em produtos de nosso cotidiano: na cloração da água potável, por sua ação bactericida; no tratamento da água de piscinas; em produtos de limpeza, como a água sanitária, que consiste numa solução aquosa de NaClO, hipoclorito de sódio, com teor de cloro ativo entre 2,0 e 2,5%; nas indústrias de papel e têxtil para branqueamento; na indústria petrolífera; em inseticidas; em medicamentos; em solventes; tintas; em tinturaria, para a lavagem a seco; na fabricação de plásticos, como o PVC; em desinfetantes e na borracha sintética [3].
O cloro também está presente na formulação de cosméticos e em alimentos de vários tipos. Os cloratos aparecem em cigarros e em explosivos. Os percloratos são também explosivos. O ácido muriático, utilizado para limpeza pesada, é uma solução de ácido clorídrico (HCl) impuro [3].
De acordo com o Conselho Mundial do Cloro, a capacidade mundial de produção de cloro é de 58 milhões de toneladas por ano. Dados do Conselho revelam que 30% do cloro produzido mundialmente é usado para produção de PVC, 5% na sanitização da água, 5% na indústria de polpa e papel, 24% em solventes, 13% em compostos orgânicos e 13% para compostos inorgânicos [4].
Papel biológico do cloro
O cloro, sob forma de íons cloreto (Cl–), existe em todos os tecidos do organismo humano e é essencial à vida. O íon cloreto tem como uma de suas maiores funções a distribuição da água nos fluidos orgânicos e nos tecidos. É o ânion mais abundante no líquido extracelular. Os cloretos são ingeridos em quantidade variável, conforme a natureza da alimentação, estando presentes no sal de cozinha, nos alimentos de origem marinha, leite, carnes, ovos e hortaliças. A média ingerida varia de 10 a 18 gramas, mas a quantidade necessária ao metabolismo normal não ultrapassa 3 a 4 gramas por dia. A maior parte do cloreto ingerido por uma pessoa é eliminada pela urina e pelo suor [4,5].
História e curiosidades
O ácido clorídrico (HCl) já era conhecido pelos antigos alquimistas. O gás cloro (Cl2) foi produzido inicialmente em 1774 por Carl Wilhelm Scheele, na Suécia, pelo aquecimento do ácido clorídrico com dióxido de manganês (MnO2), que ocorre naturalmente no mineral pirolusita, conforme mostra a reação a seguir:

Um gás denso, amarelo-esverdeado foi produzido e Scheele sentiu o cheiro sufocante desse gás, que ao ser dissolvido em água produziu uma solução ácida. Ele notou que a substância clareou o papel de tornassol e descoloriu folhas e flores [5].
Humphry Davy investigou o gás cloro em 1807 e finalmente concluiu que não apenas se tratava de uma nova substância, mas que ela continha também um novo elemento químico. Deu a ele o nome de chloros com base na palavra grega para amarelado ou verde claro. Ele anunciou a descoberta em 1810, mas só dez anos depois outros químicos efetivamente passaram a reconhecer o cloro como sendo um elemento químico [5].
No passado o cloro foi usado como arma química. Quem lançou a ideia foi o químico alemão Fritz Haber, mais conhecido por seu trabalho de síntese industrial da amônia (NH3) a partir dos gases N2 e H2. O gás venenoso foi usado inicialmente pelo exército alemão contra soldados das tropas aliadas na batalha de Ypres, durante a Primeira Guerra Mundial. Os soldados posicionavam os cilindros de gás nas linhas de frente, esperavam o vento soprar em direção ao inimigo, abriam as válvulas e corriam. Aos poucos essa tática deixou de ser utilizada, pois a experiência mostrava que um número igual de soldados morria em ambos os lados, independentemente de quem liberava o gás [5,6].
Há algumas décadas o cloro também era utilizado em sistemas de refrigeração e aerossóis, fazendo parte das moléculas dos gases conhecidos como clorofluorcarbonetos ou CFCs. O uso dos CFCs foi banido quando se descobriu que, uma vez que estejam presentes na atmosfera, esses compostos contribuem para a destruição da camada de ozônio existente na estratosfera e que protege os seres vivos da radiação ultravioleta (UV). A maior incidência dos raios UV na superfície do planeta faz com que todos fiquem mais suscetíveis ao câncer de pele [5]. No Brasil, o Ministério da Saúde proibiu em 1988 o uso dos CFCs como agentes propelentes em aerossóis, substituindo-os pelos gases butano ou propano, que são derivados de petróleo.
Referências
[1] – Greenwood N.; Earnshaw A. Chemistry of the Elements. 2. Ed.Butterworth Heinemann. 1997.
[2] – American Chemistry Council. Chlorine. Disponível em https://www.chlorine.org/chlorine-facts/. Acesso em 24/03/2022.
[3] – Vaitsman D.; Dutra P.; Afonso J. Para que servem os Elementos Químicos. Ed. Interciência. 2001.
[4] – IndrustryArc. Chlorine Market Overview. Disponível em https://www.industryarc.com/Report/15777/chlorine-market.html. Acesso em 23/03/2022.
[5] – Periodic Table. Cloro. Disponível em https://www.rsc.org/periodic-table/element/17/chlorine. Acesso em 22/03/2022.
[6] – Gray, T. Os elementos, uma exploração visual dos átomos conhecidos no Universo. 1. Ed. Blucher. 2011.
ATENÇÃO! Os experimentos com substâncias químicas mostrados nos vídeos aqui incluídos só devem ser reproduzidos na presença de um profissional ou professor de química, e em ambiente controlado. Não tente reproduzir esses experimentos por conta própria.
Texto produzido pela jornalista Mari Menda da Gerência de Relações Institucionais
do CRQ-SP
sob orientação técnica de Karem Soraia Garcia Marquez,
docente do Centro Universitário Fundação Santo André.
Publicado em 25/07/2022


