Arsênio
Arsênio
Veneno conhecido há milênios, era o preferido de Agatha Christie em suas histórias policiais30 de setembro de 2024, às 14h13 - Tempo de leitura aproximado: 8 minutos
Veneno famoso, mas também remédio

O arsênio é daqueles elementos que todos conhecem, principalmente por um de seus compostos mais famosos: o arsênico, ou trióxido de arsênio. Veneno conhecido há milênios, ele era o preferido de Agatha Christie, que o mencionou em várias de suas histórias policiais. Infelizmente, longe da ficção, este veneno foi usado em crimes reais durante milênios.
Apesar da natureza tóxica dos compostos de arsênio ser conhecida há tanto tempo, o elemento também tem uma longa história como componente dos primeiros medicamentos, e hoje está presente em compostos utilizados pela indústria.
Veneno com cheiro de alho

O elemento químico arsênio é um semimetal, com símbolo As e número atômico 33. Em sua forma metálica é brilhante, quebradiço e sua cor é prateada-acinzentada. O nome arsênio provém da palavra latina arsenicum e do grego arsenikon. Acredita-se que o químico alemão Albertus Magnus obteve o elemento no ano de 1250. Em 1649, outro químico alemão, Johann Schroeder, publicou dois métodos de preparação do elemento. [4], [1]
O arsênio tem várias formas alotrópicas: amarela (molecular não-metálica) e formas pretas e acinzentadas (semimetais), menos comuns. Três formas do arsênio com diferentes estruturas cristalinas são encontradas na natureza: os minerais de arsênio propriamente e os raros arsenolamprita e pararsenolamprita, mas ele é mais encontrado como compostos de arsenito e arsenato. Centenas de tipos desses minerais são conhecidos. [3]
O arsênio escurece em contato com o ar e, quando aquecido, oxida rapidamente, formando óxido arsenioso, que tem cheiro semelhante ao do alho. O arsênio e seus compostos são venenosos. [1]
O arsênio é quimicamente muito similar a seu predecessor, fósforo. Assim como o fósforo, ele forma óxidos sem cor, sem odor e cristalinos As2O2 e As2O5 que são higroscópicos e rapidamente solúveis em água para formar soluções ácidas. A similaridade é tão grande que o arsênio pode substituir parcialmente o fósforo (P, número atômico 15) em reações bioquímicas, mantendo-se venenoso. No entanto, em doses subtóxicas, os compostos de arsênio solúvel atuam como estimulantes e já foram populares em pequenas doses como medicamentos. [3]
Aplicações

Os compostos mais importantes deste elemento são o arsênio branco, o sulfeto, o verde Paris -também chamado de verde de Scheele, o arsenato de cálcio e o arsenato de chumbo; os três últimos têm sido usados como venenos e inseticidas agrícolas. [1]
O arsênio é usado como agente dopante em semicondutores (arsenieto de gálio, de fórmula química GaAs) em dispositivos transistorizados, com aplicações em células solares, investigação espacial e telecomunicações. Também é utilizado em pirotecnia e como endurecedor. Compostos de arsênio podem ser usados na fabricação de vidros especiais e como preservantes de madeira. [4]
O arseniato de chumbo (PbHAsO4) foi usado no século 20 como inseticida em árvores frutíferas, podendo causar danos cerebrais aos trabalhadores que o manipulavam. O Verde de Scheele, um arsenato de cobre, era usado no século 19 como agente corante. Nos últimos 50 anos o arseniato metilo monossódico (MSMA), uma forma orgânica de arsênio menos tóxica, substituiu o arseniato de chumbo na agricultura. [3]
O composto de arsênio que mais preocupa em relação à saúde pública é o arseniato de cobre cromatado, ou CCA, aplicado em boa parte das madeiras e chapas de madeira. Embora ele continue a ser usado amplamente em muitos países para prevenir infestação de insetos e roedores, principalmente depois da segunda metade do século 20, o maior problema é quando essa madeira é incinerada. Há registros de envenenamento de animais e de humanos com a ingestão direta ou indireta destas cinzas. [3]
A contaminação de águas subterrâneas por arsênio também é um grande problema, e levou a um envenenamento em massa em Bangladesh e países vizinhos, como parte da Índia, no início dos anos 1980. A Organização Mundial da Saúde estima que aproximadamente 57 milhões de pessoas em todo o mundo bebem água proveniente de fontes subterrâneas contaminadas por arsênio. [3]
Assista ao vídeo produzido pela Universidade de Nottingham sobre o paládio, com legendas traduzidas pelo professor Luís Brudna, da Universidade Federal do Pampa.
Alguns cientistas acreditam que o arsênio pode ser um elemento essencial na dieta humana em doses baixíssimas. Em doses pequenas ele é tóxico e possivelmente carcinogênico. Uma vez ingerido, ele se liga aos átomos das proteínas presentes nos cabelos, e por isso analisar amostras de cabelo pode indicar se uma pessoa foi exposta ao arsênio. Alguns alimentos, como camarão, contêm um surpreendente teor de arsênio em uma forma orgânica, menos prejudicial. [4]
Produção
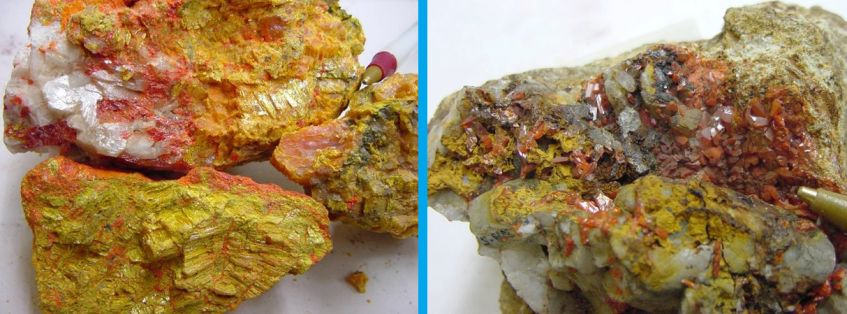
Uma pequena quantidade de arsênio é encontrada em seu estado natural. Ele este presente em minerais, como a arsenopirita; outros minerais que contêm arsênio são o realgar, o orpimento e a enargita. A maior parte do arsênio é produzida como subproduto do refino do cobre e do chumbo. Ele pode ser obtido a partir da arsenopirita por aquecimento, o arsênio sublimar e se separar do sulfeto de ferro(II). [4]
Em 2022, Peru, China e Marrocos continuaram como os maiores produtores mundiais de trióxido de arsênio, respondendo por cerca de 93% da produção mundial. A China manteve-se também como maior produtora de arsênio metálico. O arsênio metálico de alta pureza é usado para produzir semicondutores de arsenieto de gálio (GaAs), arsenieto de irídio (IrAs) e arsenieto de gálio-índio (InGaAs) utilizados em equipamentos biomédicos, em comunicações, computadores, eletrônicos e em aplicações fotovoltaicas. O número de dispositivos que utilizam arsenieto de gálio aumentou em 2022 impulsionado pela tecnologia 5G, ou de quinta geração, que se tornou o padrão para as redes de banda larga de celulares e de outros equipamentos de uso cotidiano. [2]
Ao todo foram produzidas no mundo 61 mil toneladas de arsênio em 2022, de acordo com o Sumário Mineral e Geológico dos Estados Unidos. [2]
Remédio e veneno. Veneno e remédio

Tanto o ouro-pigmento(As2S3 ou orpimento) quanto o realgar (As4S4) foram usados por Hipócrates e Aristóteles como remédio para úlceras. Na Idade Média, compostos de arsênio foram utilizados no tratamento de várias doenças, incluindo câncer, tuberculose e doenças venéreas. No início do século XVIII, o arsenito de potássio (KAsO2) e o trióxido de arsênio (As2O3) eram importantes componentes da solução de Fowler, usada no tratamento de asma, sífilis, reumatismo e distúrbios da pele. Na verdade, antes da introdução da penicilina nos anos 1950, os medicamentos contendo arsênio, chamados de salvarsan e neosalvarsan, eram os tratamentos mais comuns para sífilis. [6]

Na Inglaterra vitoriana, as lojas de secos e molhados vendiam chá, biscoitos, açúcar, farinha, arroz e arsênio. Papel de parede, cerveja, vinhos, doces, papel de embrulho, brinquedos pintados, inseticidas, roupas, cadáveres, animais empalhados, ornamentos para chapéus, velas: tudo isso continha arsênio. Sem regulamentação até boa parte do século 19, o arsênio estava disponível para quem quisesse comprar. [5]
Fornecido em pequenas quantidades por um certo período de tempo o arsênio produz um gradual declínio na saúde da vítima, e os sintomas são facilmente atribuídos a alguma doença. Confirmar o arsênio como a causa de uma morte exigia não apenas autópsias, mas conhecimento de como o elemento agia no corpo e métodos confiáveis para detectá-lo em amostras orgânicas. Em 1814 Mateu Orfila publicou o primeiro texto sobre toxicologia; em 1836 o químico James Marsh desenvolveu o teste Marsh, que conseguia identificar minúsculas quantidades de arsênio em alimentos e em restos humanos; em 1841 Hugo Reinsch desenvolveu um teste simples para o arsênio usando água, ácido clorídrico e uma folha de cobre. Assassinatos usando arsênio passaram a ser detectáveis. [5]
Os envenenamentos de famosos por arsênio desde o Império Romano, crimes cometidos com este veneno e o uso do arsênio em medicamentos estão relatados numa apresentação ilustrada publicada neste link.
Referências:
[1] Arsenic4. Disponível em https://periodic.lanl.gov/33.shtml. Acessado em 20/09/2023.
[2] Arsenic. Disponivel em https://pubs.usgs.gov/periodicals/mcs2023/mcs2023-arsenic.pdf. Acessado em 20/09/2023.
[3] Arsenic2. Disponível em https://www.chemeurope.com/en/encyclopedia/Arsenic.html. Acessado em 20/09/2023.
[4] Arsenic3. Disponível em https://www.rsc.org/periodic-table/element/33/arsenic. Acessado em 20/09/2023.
[5] An Everyday Poison. Disponível em https://www.sciencehistory.org/stories/magazine/an-everyday-poison/. Acessado em 20/09/2023.
[6] Rodgers, G. E. (2016). Química inorgânica descritiva, de coordenação e do estado sólido. São Paulo: Cengage Learning.
ATENÇÃO! Os experimentos com substâncias químicas mostrados nos vídeos aqui incluídos só devem ser reproduzidos na presença de um profissional ou professor de química, e em ambiente controlado. Não tente reproduzir esses experimentos por conta própria.
Texto produzido pela jornalista Mari Menda, da Gerência de Relações Institucionais do CRQ-SP, e revisado pela Profa. Márcia Guekezian, coordenadora do curso de Engenharia Química da Faculdade de São Bernardo do Campo – FASB.
Publicado em 30/09/2024


