Oxigênio
Oxigênio
Azul, essencial e poderoso: este é oxigênio

O oxigênio é essencial a todas as formas de vida superiores. Ocorre na atmosfera em vastas quantidades como gás O2 e como gás ozônio (O3) em quantidades minoritárias. Também existem quantidades substanciais de gás oxigênio (O2) dissolvidas nos oceanos e nas águas superficiais de todo o mundo. Todo este oxigênio tem origem biológica, sendo gerado por seres fotossintetizantes a partir da água e dióxido de carbono. A reação de fotossíntese pode ser representada por:
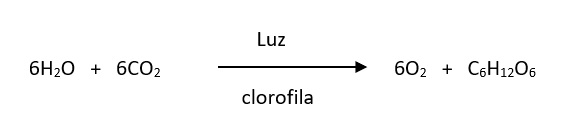
O gás oxigênio produzido na fotossíntese é consumido no processo de respiração aeróbica, realizado por organismos superiores [1].
O oxigênio é o terceiro elemento mais abundante no universo e compõe cerca de 21% da atmosfera terrestre. Ele responde por quase metade da massa da crosta terrestre, dois terços da massa do corpo humano e nove décimos da massa da água. Grandes quantidades de oxigênio podem ser extraídas do ar liquefeito por meio de um processo conhecido como destilação fracionada. Ele também pode ser produzido por eletrólise da água ou por aquecimento de clorato de potássio (KClO3) [2].
O oxigênio é um elemento classificado como não-metal, tem número atômico 8, e pertence ao grupo 16 da tabela periódica. Os elementos desse grupo, oxigênio, enxofre, selênio, telúrio e polônio, são normalmente chamados de calcogênios.
O oxigênio é quimicamente bastante diferente dos outros membros do grupo. Ele é o segundo elemento mais eletronegativo da tabela periódica e significativamente mais eletronegativo do que os seus congêneres. Essa alta eletronegatividade tem uma grande influência nas propriedades químicas do elemento [1].
Assista o vídeo produzido pela Universidade de Nottingham, no Reino Unido, e disponibilizado no canal de YouTube Periodic Table of Videos:
Na lua e no nosso DNA – O oxigênio ocorre combinado na forma de inúmeros compostos. Além de estar presente na atmosfera, ele compreende 46% da crosta terrestre e mais de 85% da hidrosfera, sendo 85% dos oceanos e 88% da água pura. Ele também é o elemento mais abundante na superfície da lua (crosta lunar) onde se encontra na forma combinada, na proporção de 60%, em média [3].
Oxigênio está também em virtualmente cada molécula de nosso corpo, incluindo gorduras, carboidratos, proteínas e DNA. Em particular, é o átomo que mantém ligados os grupos dos fosfatos e a molécula de ATP, que carrega a energia [3].
O oxigênio nos mantém vivos, mas também é amplamente usado na indústria como um poderoso oxidante. Uma corrente de oxigênio pode elevar a temperatura de um alto-forno em mais de 2.000°C e permite que um maçarico de oxiacetileno faça um corte reto num metal. Os foguetes espaciais sobem ao espaço por meio da incrível energia liberada quando o oxigênio (O2) e o hidrogênio (H2) se combinam para produzir água [3].
Ozônio e aurora boreal – Além do gás oxigênio (O2), fundamental para os seres vivos, outra importante forma alotrópica do elemento é o gás ozônio (O3). A presença desse gás é muito importante na estratosfera, uma das camadas superiores que compõem a atmosfera, onde atua como um filtro que retém parte dos perigosos raios ultravioleta, provenientes do sol. Por outro lado, quando presente na troposfera (camada mais baixa da atmosfera e mais próxima da superfície terrestre), o gás ozônio é considerado um poluente, por ser nocivo aos seres vivos. Normalmente, o ozônio encontra-se em quantidades tão rarefeitas na atmosfera que é impossível poder observar a sua cor azul clara. [3].

O gás oxigênio é incolor, porém, quando está na sua forma líquida apresenta cor azul. A aurora boreal, ou luzes polares, ocorre quando partículas do vento solar colidem com os átomos de oxigênio e também de nitrogênio na alta atmosfera, e produzem ondas verdes e vermelhas no céu, que encantam os humanos há milênios [3].
Veja como se forma a extraordinária aurora boreal, em vídeo publicado no canal de YouTube Mundo Curioso:
Pioneiros – A descoberta do oxigênio é geralmente creditada a C.W. Scheele e J. Priestley (em 1773/74), embora vários outros pesquisadores anteriormente tenham feito observações importantes, entre eles Leonardo da Vinci, sem na verdade, isolar e caracterizar o gás. Apesar disso, é difícil atribuir um significado correto para a palavra “descoberta” quando aplicado a um elemento tão onipresente quanto o oxigênio, particularmente quando as experiências sobre combustão e respiração eram interpretadas à luz da obsoleta teoria do flogisto [3]. Esta era uma teoria segundo a qual as substâncias combustíveis liberavam uma matéria chamada flogisto no processo de combustão.
Além disso, as dificuldades tecnológicas antes da metade do século XVIII para isolar e manipular compostos gasosos agravavam o problema, e por isso parece claro que vários pesquisadores conseguiram trabalhar com oxigênio sem na verdade, isolá-lo ou reconhecê-lo como um constituinte comum do ar. Scheele, um farmacêutico de Uppsala, na Suécia, preparou oxigênio várias vezes entre 1771 e 1773 ao aquecer KNO3, Mg (NO3)2, Ag2CO3, HgO e uma mistura de H3AsO4 e MnO2. Ele chamava aquele gás de “ar vitríolo” e notou que não tinha cor, odor ou gosto, e entrava em combustão melhor que o ar, mas os resultados de suas descobertas não apareceram até 1777 por problemas de publicação [3].
O experimento clássico de Priestley para calcinar HgO confinado num cilindro invertido com mercúrio líquido foi realizado pela primeira vez em Colne, Inglaterra, em agosto de 1774. Ele relatou o experimento para Antoine Lavoisier num jantar festivo em Paris em outubro de 1774 e publicou os resultados em 1775, depois de mostrar que o gás era diferente de óxido nitroso. Os engenhosos experimentos de Priestley estabeleceram o oxigênio como uma substância, mas foi a visão mais profunda de Lavoisier que reconheceu que o gás continha um novo elemento, o que foi a chave para o atual entendimento da natureza de sua combustão. Isto enterrou de vez a teoria do flogisto e lançou as bases da química moderna. Lavoisier chamou o elemento de “oxygéne” em 1777 ao acreditar erroneamente que ele era um constituinte essencial de todos os ácidos (do grego, oxys, azedo; e geinomai, que produz, ou seja, formador de ácido) [3].
Usos – O oxigênio (O2) é geralmente transportado e estocado em grandes volumes na sua forma liquefeita. No entanto, muitas aplicações usam oxigênio na sua forma gasosa. Os usos principais do oxigênio se relacionam com suas propriedades de forte oxidação e de sustentação da vida. Oxigênio é normalmente usado na área de saúde e aplicações médicas (clique aqui para ler a matéria “Como é produzido o oxigênio hospitalar”, publicada no site do Conselho Federal de Química). O oxigênio líquido é usado como oxidante para combustíveis líquidos nos sistemas de propulsão de mísseis e foguetes. Também é amplamente aplicado nas indústrias metalúrgicas, junto com acetileno e outros gases combustíveis, para corte de metal, moldagem, encaixe, endurecimento, limpeza e derretimento [4].
Usinas de aço e ferro também usam amplamente o oxigênio ou ar enriquecido com oxigênio nos processos de refinação química e no aquecimento relacionado com a remoção do carbono e outras reações de oxidação. Benefícios como economia de combustível e de energia, além do baixo volume de emissões, são normalmente obtidos quando o ar é enriquecido ou substituído por oxigênio de alta pureza. Nas indústrias químicas e de petróleo, o oxigênio é usado como componente para produzir compostos químicos, como álcoois e aldeídos. Em muitos processos, o oxigênio pode ser obtido a partir do ar. Existem várias etapas de produção na indústria petroquímica que são feitas com oxigênio de alta pureza, como, por exemplo, etileno e óxido de propileno (anticongelante), cloreto de vinilo (para PVC) e caprolactama (para nylon). A indústria de polpa e de papel usa oxigênio como agente branqueador e oxidante [4].
Além disso, o oxigênio melhora o processo de combustão em indústrias que produzem vidro, alumínio, cobre, ouro, chumbo e cimento ou que estão envolvidas na queima de lixo. Todos esses processos registram ganhos de produtividade, energia, manutenção e reduções nas emissões para seus usuários finais. Estações de tratamento de águas servidas utilizam oxigênio com sucesso para melhorar a eficiência do seu processo químico [4].
Referências
[1] – Weller M.; Overton T.; Rourke J.; Armstrong F. Química Inorgânica. 6. Ed. Bookman. 2017.
[2] – Oxigênio. Disponível em https://education.jlab.org/itselemental/ele008.html. Acesso em 03/03/2022.
[3] – Greenwood N.; Earnshaw A. Chemistry of the Elements. Butterworth Heinemann. 2.ed. 1997.
[4] – Oxigênio. Disponível em https://ehs.mit.edu/wp-content/uploads/2020/01/safety_gram_6_OXYGEN.pdf. Acesso em 03/03/2022.
ATENÇÃO! Os experimentos com substâncias químicas mostrados nos vídeos aqui incluídos só devem ser reproduzidos na presença de um profissional ou professor de química, e em ambiente controlado. Não tente reproduzir esses experimentos por conta própria.
Texto produzido pela jornalista Mari Menda, da Gerência de Relações Institucionais do CRQ-SP, e revisado por Karem Soraia Garcia Marquez, docente do
Centro Universitário Fundação Santo André.
Publicado em 27/02/2022


