Artigo – 150 anos da Tabela Periódica
Artigo – 150 anos da Tabela Periódica

por Paulo Porto*
Até o século XVII, era comum entre os eruditos ocidentais acreditar que toda a matéria seria formada a partir de um pequeno número de substâncias ou princípios elementares. Desde a Antiguidade, muitos foram os filósofos naturais, alquimistas ou outros estudiosos que trabalharam com a ideia de que haveria quatro elementos: terra, água, ar e fogo, cuja combinação daria origem a toda a diversidade de materiais que se apresentam na Natureza. Nos séculos XVI e XVII, a partir das ideias de Paracelso (1493-1541) e de seus seguidores, muitos autores adotaram a concepção de que três princípios poderiam ser separados de todos os materiais, por meio de operações (al)químicas: enxofre, mercúrio e sal (que não devem ser confundidos com as substâncias chamadas atualmente por esses nomes). Esses princípios eram entendidos como portadores de qualidades, algumas das quais exemplificamos a seguir: o enxofre daria aos corpos a propriedade de ser combustível, inflamável; o mercúrio seria o princípio que daria aos corpos a propriedade de ser maleável, fusível, fluido; e o sal seria o portador da propriedade de ser fixo, sólido, não inflamável. De qualquer forma, ao longo do século XVII surgiram na Europa outras ideias a respeito de quais seriam os elementos constituintes de todos os materiais, e não havia um consenso generalizado em torno dessa questão.

Foi somente no final do século XVIII que Antoine Lavoisier (1743-1794) propôs outra concepção de elemento químico, como sendo todo material que não pudesse ser decomposto em nada mais simples pelos métodos químicos então conhecidos. Muitos químicos viram, então, que era mais conveniente trabalhar com essa definição do que continuar procurando substâncias que pudessem estar presentes em todos os materiais. Essa conveniência estava relacionada também a uma nova nomenclatura sistemática, criada por Lavoisier e outros químicos franceses, e a uma abordagem quantitativa que pressupunha a conservação das massas e dos elementos em qualquer transformação química. Por outro lado, o número de elementos aumentou bastante: em vez de três ou quatro, Lavoisier identificou mais de vinte substâncias que não podiam ser decompostas pelas técnicas de separação conhecidas em sua época.
No início do século XIX, John Dalton (1766-1844) associou a ideia de Lavoisier sobre os elementos com a ideia de átomos1: as substâncias simples (elementares) seriam formadas por apenas um tipo de átomo. Cada tipo de átomo seria caracterizado por propriedades específicas, entre as quais as suas massas. Dalton então determinou experimentalmente as massas atômicas relativas, características de cada elemento2.
À medida que o século XIX avançava, o número de elementos químicos conhecidos foi aumentando rapidamente, devido ao desenvolvimento das técnicas de análise química, especialmente a eletrólise. Assim, na década de 1870 já eram conhecidos mais de 60 elementos. Com o aumento do número de elementos, os químicos passaram a observar semelhanças entre as propriedades de alguns deles.
Na década de 1820, o químico alemão Johannes Döbereiner (1780-1849) observou a existência de grupos de três elementos (chamados de tríades) que apresentavam propriedades químicas semelhantes. Por exemplo, os metais lítio, sódio e potássio são menos densos que a água e reagem com ela, liberando gás hidrogênio e formando os respectivos hidróxidos em solução. Mas Döbereiner observou também que havia uma relação quantitativa entre as massas atômicas desses três elementos: a massa atômica do sódio era aproximadamente igual à média aritmética entre as massas atômicas do lítio e do potássio. Outras tríades exibiam relações semelhantes: cloro, bromo e iodo; cálcio, estrôncio e bário; enxofre, selênio e telúrio. Em todos esses casos, cada tríade reunia três elementos com propriedades químicas semelhantes; e em cada uma delas a massa atômica do segundo elemento era aproximadamente a média aritmética das massas atômicas dos outros dois.
O crescente número de elementos levou os químicos a buscarem alguma forma de classificá-los, e o trabalho de Döbereiner indicou que as massas atômicas poderiam ser um critério para isso. Muitos químicos elaboraram propostas para classificar os elementos conhecidos em sua época com base na semelhança de propriedades: Leopold Gmelin (1788-1853), William Odling (1829-1921), John Newlands (1837-1898) e Alexandre Chancourtois (1820-1886) foram alguns deles (Figuras 1 e 2).

No entanto, havia dificuldades tanto de caráter teórico como experimental. Por exemplo, havia divergência quanto aos valores experimentais de algumas massas atômicas, o que dificultava a observação de regularidades nas propriedades dos elementos ao tentar ordená-los. Um avanço para a superação dessas dificuldades ocorreu em 1860, quando químicos de vários países se reuniram no Congresso de Karlsruhe. A divulgação do trabalho de Stanislao Cannizzaro (1826-1910) sobre a determinação de massas atômicas permitiu que alguns valores fossem corrigidos.
A maior contribuição para a classificação periódica dos elementos foi feita pelo químico russo Dmitri Mendeleev (1834-1907). Durante muitos anos, Mendeleev trabalhou em tentativas de fazer uma classificação e sua primeira versão de uma Tabela Periódica foi elaborada enquanto ele escrevia um livro didático de química para ser utilizado nas universidades russas.
De acordo com relatos do próprio Mendeleev, uma de suas estratégias para a classificação foi utilizar cartões, um para cada elemento conhecido, contendo o símbolo do elemento, sua massa atômica e suas principais propriedades químicas. Mendeleev usou esses cartões para tentar descobrir como seria possível classificar os elementos – mas usou, principalmente, sua intuição de químico experiente. Mendeleev não se limitou a organizar os elementos em ordem crescente das massas atômicas determinadas na época. Ele percebeu que os elementos com propriedades semelhantes poderiam ser representados em grupos em uma tabela; mas, para que essa semelhança pudesse ser observada como uma função das massas atômicas, seria necessário deixar espaços vazios na tabela. Além disso, ele precisou supor também que os valores de algumas massas atômicas haviam sido determinados incorretamente (ainda que ele próprio não tivesse nenhuma evidência experimental disso). Por exemplo, em sua época havia dúvida se a fórmula do óxido de berílio seria BeO ou Be2O3 – e a consequência disso era que a massa atômica do berílio poderia ser aproximadamente 9 (no primeiro caso) ou 14 (no segundo). Observando as propriedades químicas do berílio, Mendeleev concluiu que elas representavam uma transição entre as propriedades químicas do lítio (massa atômica = 7) e as do boro (massa atômica = 11). Assim sendo, concluiu que a massa atômica do berílio deveria ser 9 e não 14, e colocou esse elemento entre o lítio e o boro em sua tabela. Acreditando que o critério da semelhança das propriedades químicas deveria prevalecer sobre o valor então determinado para algumas massas atômicas, Mendeleev construiu uma tabela contendo mais elementos e mostrando mais regularidades do que todas as tentativas anteriores de classificação dos elementos – ainda que, para isso, ele tenha precisado inverter a posição de alguns elementos na sequência crescente de massas atômicas, mesmo sem ter evidências de que houvesse erro na determinação dessas massas atômicas.
Outra ideia de Mendeleev que foi fundamental para chegar à classificação periódica mais completa e útil até então foi deixar espaços vazios na sequência dos elementos, de modo a permitir que elementos com propriedades químicas semelhantes ficassem na mesma coluna, mostrando a repetição periódica das propriedades em função das massas atômicas. Os espaços vazios sugeriam que nem todos os elementos químicos eram conhecidos, ou seja, que poderiam existir elementos que viriam a ocupar os espaços vazios da tabela.
Mendeleev levou adiante essa suposição. Usando seu conhecimento das propriedades experimentais dos elementos conhecidos e a ideia de que essas propriedades variavam com uma regularidade que poderia ser determinada pela comparação entre os elementos situados em posições consecutivas na tabela, Mendeleev publicou, em 1871, um artigo no qual descreveu as propriedades de três elementos químicos até então desconhecidos e que deveriam ocupar três dos espaços então vazios na Tabela Periódica. Cerca de quinze anos depois desse artigo, todos os três elementos previstos já haviam sido descobertos na Natureza – e suas propriedades, determinadas experimentalmente, correspondiam àquelas previstas por Mendeleev com notável precisão. Esse sucesso reforçou a confiança dos químicos de que a Tabela Periódica resultava de uma estrutura fundamental da Natureza. Mendeleev fez outras previsões a respeito de elementos químicos que poderiam vir a ser descobertos, mas muitas dessas outras previsões não se confirmaram, especialmente de elementos que ele acreditava terem massas atômicas menores que a do hidrogênio.
Continuando sua busca pela maneira mais adequada de representar sua classificação periódica dos elementos, Mendeleev percebeu que as relações entre os elementos ficariam mais claras se invertesse as posições das colunas e das linhas de sua tabela original. Assim, em 1871 publicou uma versão de sua tabela com o arranjo que se tornou mais utilizado dali para a frente: reunindo os elementos com propriedades químicas semelhantes nas colunas (Figura 3).
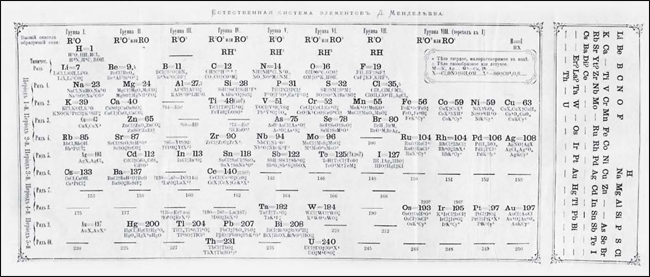
Entretanto, no início do século XX foram observados alguns fenômenos que, a princípio, pareciam ser difíceis de conciliar com a Tabela Periódica. A descoberta da radioatividade levou à constatação da existência de novos elementos químicos, que podiam ser adicionados à tabela. Porém, alguns dos elementos radioativos pareciam emitir “emanações” (como foram chamadas na época), de natureza então desconhecida. Também se observou que os elementos radioativos se transformavam em outros elementos, refutando a ideia de que os átomos seriam imutáveis. Foram observadas diferentes séries de decaimentos radioativos, mas não estava claro se seus intermediários eram novos elementos, ou como seria possível classificá-los. Observou-se, ainda, que alguns desses intermediários tinham propriedades químicas idênticas às de elementos conhecidos, mas suas massas atômicas eram diferentes destes. Isso desafiava a ideia de que os elementos químicos eram caracterizados por suas massas atômicas, concepção que fundamentava a própria classificação periódica dos elementos.
As soluções para esses problemas foram sendo lentamente construídas ao longo das duas primeiras décadas do século XX pelos trabalhos de muitos cientistas. Entre essas contribuições incluem-se a caracterização do elétron como partícula subatômica; a proposição de modelos em que os átomos têm estrutura, com um núcleo portador de carga elétrica positiva; e a identificação de diferentes tipos de radioatividade, chamadas de alfa, beta e gama. Outro passo fundamental foi a proposição do conceito de número atômico. Em 1911, Antonius van den Broek (1870-1926) formulou a hipótese de que o número de cargas no núcleo de um átomo seria igual à posição do respectivo elemento na Tabela Periódica (sendo o hidrogênio o primeiro, o hélio o segundo, e assim por diante). Essa ideia foi sendo elaborada e, em 1913, recebeu um importante reforço experimental com o trabalho de Henry Moseley (1887-1915), que mostrou haver uma relação entre a frequência de determinadas linhas dos espectros de emissão de raios-X dos elementos e números inteiros, que podiam ser relacionados às respectivas posições dos elementos na Tabela Periódica.
Com a consolidação do conceito de número atômico, chegou-se a um consenso de que os elementos químicos seriam mais bem caracterizados não por suas massas atômicas, mas pelo número de cargas positivas no núcleo de seus átomos. Ou seja, os números atômicos substituíram as massas atômicas como critério para o ordenamento dos elementos na Tabela Periódica. Isso permitiu uma explicação para o problema da caracterização dos átomos intermediários formados nas séries radioativas. Assim, todos os átomos formados que tivessem o mesmo número atômico (quaisquer que fossem suas massas atômicas) pertenceriam ao mesmo elemento químico. Consequentemente, deveriam ocupar o mesmo lugar na Tabela Periódica – por isso, foram chamados de isótopos (do grego: iso- = igual; topos = lugar). A caracterização das partículas subatômicas chamadas de nêutrons, em 1932, permitiu uma explicação para o fenômeno da isotopia: átomos de um mesmo elemento têm o mesmo número de prótons (partículas com carga positiva) em seus núcleos, mas podem ter diferentes números de nêutrons, sendo que a soma do número de prótons e nêutrons é responsável por quase toda a massa de um dado átomo.
Em 1905, pouco antes de seu falecimento, Mendeleev anotou em seu diário pessoal: “Penso que a lei periódica não será ameaçada no futuro; pelo contrário, ela será desenvolvida e aperfeiçoada” 3. Mendeleev tinha razão: a Tabela Periódica tornou-se um instrumento utilíssimo para os químicos e para todos que, de alguma forma, fazem uso de conhecimentos químicos. A Tabela Periódica está presente, também, na Educação Básica para a cidadania – não para que sejam memorizados os nomes, símbolos e números nela presentes (o que, por si mesmo, seria apenas um conhecimento estéril e inútil) – mas para que todos possam ter um efetivo entendimento de seu significado e das informações contidas na Tabela. As palavras de Eric Scerri resumem bem a importância da Tabela Periódica para a ciência:
| A tabela periódica dos elementos é um dos ícones mais poderosos da ciência: um documento único que captura a essência da química num elegante padrão. De fato, não existe nada semelhante na biologia ou na física, ou em qualquer outro ramo da ciência. Pode-se ver tabelas periódicas em toda parte: em laboratórios industriais, oficinas, laboratórios acadêmicos e, é claro, em salas de aula4. |
Na ocasião em que se comemoram 150 anos da publicação da Tabela Periódica de Mendeleev, esperamos que essa notável construção da ciência possa ser, cada vez mais, conhecida e compreendida por todos.
Notas:
1 – Ideias sobre átomos ou corpúsculos já estavam bastante difundidas entre os estudiosos europeus desde o século XVII. Dalton foi particularmente influenciado pelas concepções sobre átomos contidas nas obras de Isaac Newton (1643-1727) e de seus divulgadores.
2 – Para saber como Dalton fez isso, vide: H. E. B. Viana e P. A. Porto; O Processo de Elaboração da Teoria Atômica de John Dalton. Cadernos Temáticos de Química Nova na Escola, v. 7, p. 4-12, 2007.
3 – Mendeleev, citado por I. V. Petrianov e D. N. Trifonov, A Lei Grandiosa (Moscou: Editora Mir, 1987), p. 114.
4 – E. R. Scerri, The Periodic Table – its story and its significance. New York: Oxford University Press, 2007, p. xiii.
Para saber mais:
● M. Alfonso-Goldfarb, M. H. M. Ferraz, M. H. R. Beltran e P. A. Porto; Percursos de História da Química. São Paulo: LF Editorial, 2016.
● H. S. A. Leite e P. A. Porto; Análise da abordagem histórica para a Tabela Periódica em livros de Química Geral para o ensino superior usados no Brasil no século XX. Química Nova, v. 38, p. 580-587, 2015.
● F. A. S. P. Baia; Átomos, elementos químicos, planetas e estrelas – concepções de Mendeleev sobre o mundo microscópico. Dissertação (Mestrado em Ensino de Química) – Universidade de São Paulo, São Paulo, 2011. Disponível em: https://is.gd/tabela_dissertacao. Acesso em: 11 dez 2018.
Sobre o autor (*)
Paulo Alves Porto é bacharel e licenciado em química pela Universidade de São Paulo, mestre e doutor em Comunicação e Semiótica (área de pesquisa: História da Ciência) pela Pontifícia Universidade Católica de São Paulo, livre-docente na área de Ensino de Química pela USP, professor associado do Departamento de Química Fundamental do IQ-USP. Contatos podem ser feitos pelo e-mail palporto@iq.usp.br.


